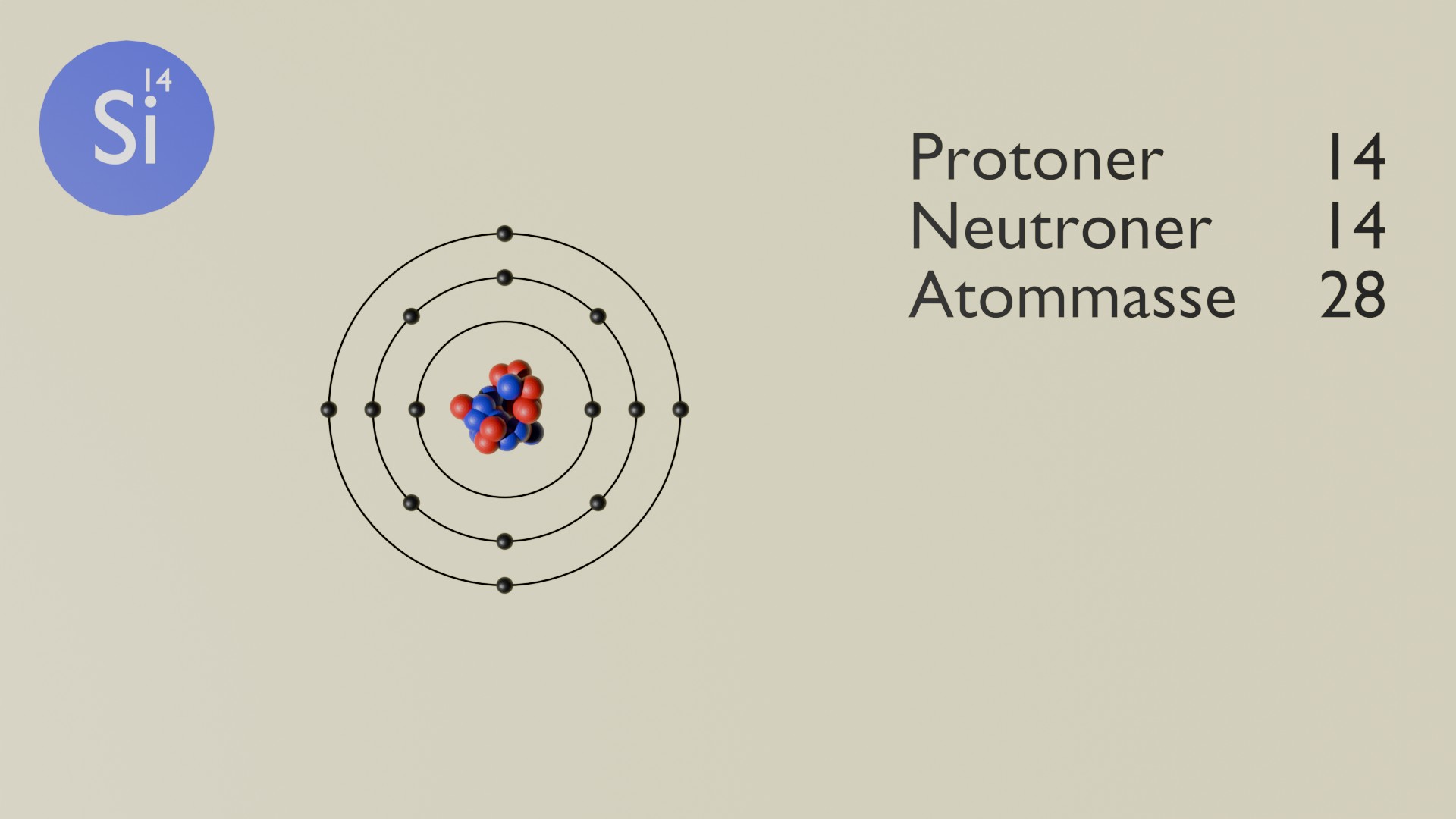
Silicium (Si) er et kemisk grundstof med atomnummer 14. Det er et halvmetal og tilhører gruppe 14 i det periodiske system. Silicium er det næstmest forekommende grundstof i jordskorpen og er fundamentalt for både teknologi og geologi.
Silicium har 14 protoner, typisk 14 neutroner og 14 elektroner. Det forekommer ikke frit i naturen, men findes i rigelige mængder som silikater og kvarts. Det spiller en nøglerolle i fremstilling af elektronik og glas samt i biologiske og geologiske processer.
Silicium er et gråligt, skinnende halvmetal, som er sprødt og har en krystallinsk struktur. Det opfører sig som en ikke-leder ved lave temperaturer, men som en halvleder ved højere temperaturer – hvilket gør det ideelt til elektronik.
- Smeltepunkt: 1.414 °C
- Kogepunkt: 3.265 °C
- Halvleder – elektrisk ledningsevne kan kontrolleres
Kemisk er silicium relativt stabilt, men det kan reagere med halogener og stærke baser.
Naturligt silicium består af tre stabile isotoper:
- Silicium-28 (²⁸Si): ca. 92,2 %
- Silicium-29 (²⁹Si): ca. 4,7 %
- Silicium-30 (³⁰Si): ca. 3,1 %
Alle isotoper er stabile og bruges i forskning og avancerede materialeanalyser.
Silicium er et af de mest anvendte grundstoffer i moderne teknologi og industri:
| Anvendelse | Beskrivelse |
| Elektronik og solceller | Bruges i halvlederchips, transistorer og solcellepaneler på grund af dets kontrollerbare ledningsevne. |
| Byggematerialer | Forekommer i cement, beton og glas i form af siliciumdioxid (SiO₂). |
| Keramik og optik | Indgår i varmebestandige og optiske materialer som kvarts- og silikatglas. |
| Legeringer | Silicium tilsættes aluminiumlegeringer for at forbedre støbeegenskaber. |
Silicium findes i jordskorpen som silikater og kvarts og udgør ca. 27 % af dens masse. Det er ikke essentielt for mennesker, men spiller en vis rolle i bindevæv og knogler. Hos planter og visse havorganismer (diatoméer) indgår silicium i opbygning af cellevægge og skeletstrukturer.