


Det periodiske system er en tabelformet opstilling af de kemiske elementer, organiseret på basis af deres atomnummer, elektronkonfigurationer og kemiske egenskaber. Elementerne er arrangeret i rækker (kaldet perioder) og kolonner (kaldet grupper eller familier) i rækkefølge efter stigende atomnummer.
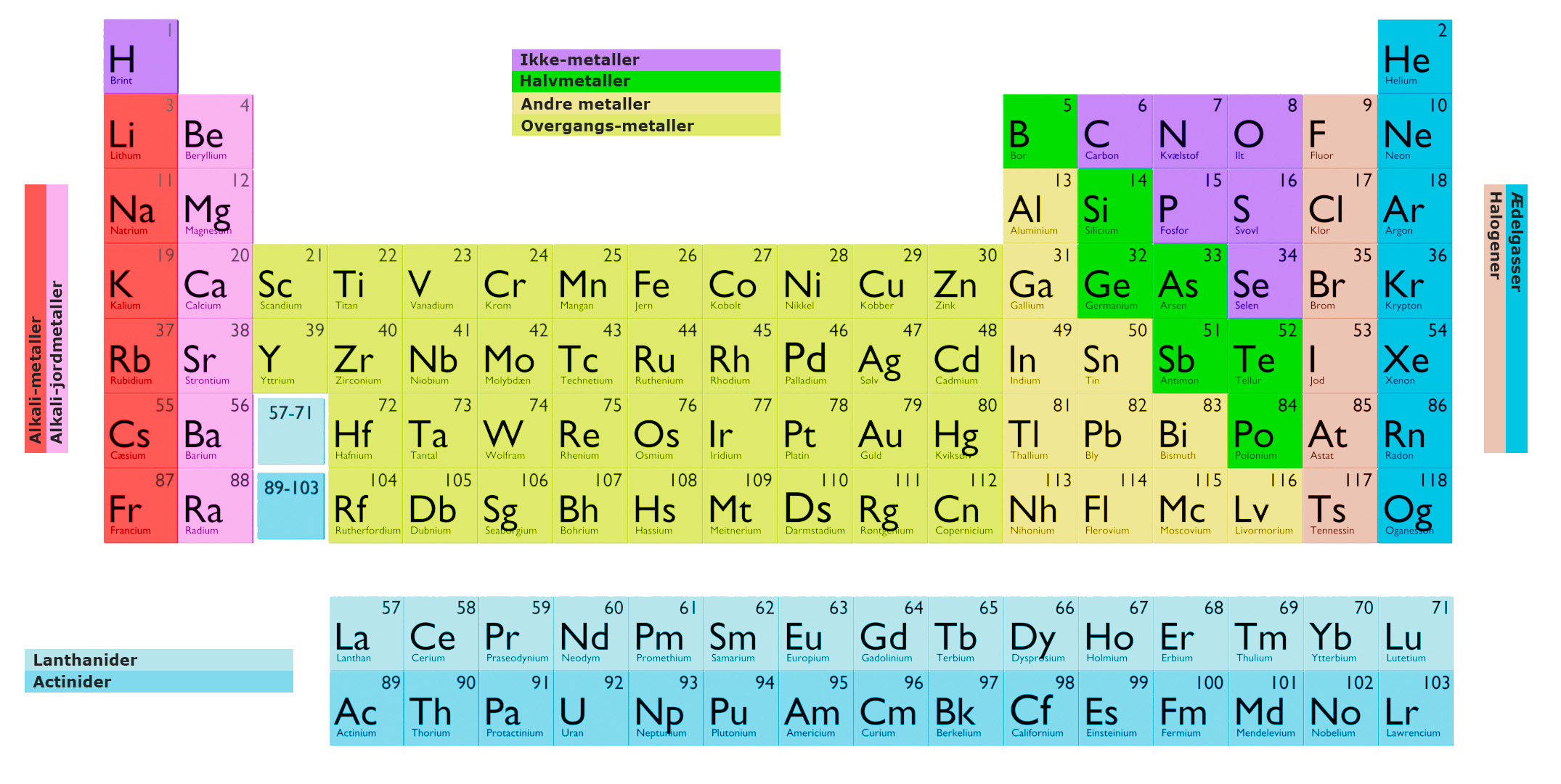
Hvert element er repræsenteret af et unikt kemisk symbol, typisk et eller to bogstaver, som bruges til at identificere det i det periodiske system. Elementerne er også grupperet i kategorier baseret på deres fysiske og kemiske egenskaber.
Grundstofferne i den første kolonne (kaldet gruppe 1) kaldes alkalimetaller og har lignende egenskaber. Grundstofferne i den anden kolonne (gruppe 2) kaldes jordalkalimetaller og har lignende egenskaber. Grundstofferne i de næste seks kolonner (grupperne 3-8) kaldes overgangsmetaller og har lignende egenskaber. Grundstofferne i den sidste kolonne (gruppe 18) kaldes ædelgasserne og har lignende egenskaber.
Rækkerne i det periodiske system kaldes perioder. Den første række (periode 1) har kun to grundstoffer, brint og helium. De næste rækker har 8 grundstoffer hver, fra periode 2 til periode 7.
Grundstofferne i samme periode har lignende elektronkonfigurationer, men når man bevæger sig fra venstre mod højre på tværs af en periode, stiger atomnummeret, hvilket fører til en stigning i antallet af protoner i kernen, hvilket igen fører til en stigning i antallet af elektroner i den yderste skal, hvilket fører til forskellige kemiske og fysiske egenskaber.
Elementerne i den samme gruppe (eller kolonne) har lignende kemiske egenskaber, fordi de har det samme antal elektroner i deres yderste skal.
Det periodiske system er et effektivt værktøj til at forudsige egenskaber og opførsel af elementer og deres forbindelser, og det er meget anvendt i kemi og andre videnskaber.
Alkalimetallerne er en gruppe af grundstoffer i det periodiske system, der er placeret i gruppe 1 (IA). De er karakteriseret ved at have én valenselektron i deres yderste skal. De har lignende kemiske og fysiske egenskaber, og de er meget reaktive. Alkalimetallerne er:
| Grundstof | Beskrivelse |
|---|---|
| Lithium (Li) | Det letteste alkalimetal og det mindst reaktive. Det bruges i batterier og andre anvendelser. |
| Sodium (Na) | Det mest almindelige alkalimetal, der anvendes i mange industrielle processer, herunder produktion af glas, sæbe og kemikalier |
| Potassium (K) | Bruges i gødning, fyrværkeri og andre anvendelser |
| Rubidium (Rb) | Mindre almindelig og bruges i specialiserede applikationer, såsom atomure og forskning |
| Cesium (Cs) | Er heller ikke almindeligt brugt |
| Francium (Fr) | Det sjældneste og mest ustabile alkalimetal og findes kun i små mængder i naturen |
Alkali-jordmetallerne er en gruppe af grundstoffer i det periodiske system, der er placeret i gruppe 2 (IIA). De er karakteriseret ved at have to valenselektroner i deres yderste skal. De har lignende kemiske og fysiske egenskaber, og de er mindre reaktive end alkalimetallerne. Alkali-jordmetallerne består af :
| Grundstof | Beskrivelse |
|---|---|
| Beryllium (Be) | Et let og stærkt metal med unikke egenskaber, der gør det nyttigt inden for luftfart, atomkraft og andre højteknologiske applikationer |
| Magnesium (Mg) | >Anvendes i legeringer, fyrværkeri og som katode i batterier |
| Calcium (Ca) | Et essentielt element for levende organismer og det mest udbredte metal i menneskekroppen. Det bruges i byggeindustrien til fremstilling af cement og kalk |
| Strontium (Sr) | Bruges i nødblus, fyrværkeri og som kilde til strontium-90, en radioaktiv isotop, der bruges i medicinske behandlinger. |
| Barium (Ba) | Used in the oil and gas industry, and in the production of glass and ceramics |
| Radium (Ra) | Radioactive and it is only found in small amounts in nature and it has no commercial application |
Overgangsmetallerne er en gruppe af grundstoffer i det periodiske system, der er placeret i grupperne 3-12 (IIIB-IIB) og omfatter lanthanid- og actinidserien. De er karakteriseret ved at have delvist fyldte d-orbitaler i deres yderste skal.
De har forskellige kemiske og fysiske egenskaber og er kendt for deres høje smelte- og kogepunkter samt høje densiteter. De er også kendt for deres evne til at danne flere oxidationstrin og for deres farvede forbindelser. Nogle af de almindelige overgangsmetaller er:
| Grundstof | Beskrivelse |
|---|---|
| Scandium (Sc) | |
| Vanadium (V) | |
| Chromium (Cr) | |
| Manganese (Mn) | |
| Iron (Fe) | |
| Cobalt (Co) | |
| Nickel (Ni) | |
| Copper (Cu) | |
| Zinc (Zn) | |
| Molybdenum (Mo) | |
| Ruthenium (Ru) | |
| Rhodium (Rh) | |
| Palladium (Pd) | |
| Silver (Ag) | |
| Cadmium (Cd) | |
| Mercury (Hg) | |
| Platinum (Pt) | |
| Gold (Au) |
| Grundstof | Beskrivelse |
|---|---|
| Helium (He) | Det næstletteste element og bruges i balloner, luftskibe og som kølemiddel til kryogenik |
| Neon (Ne) | Bruges i reklameskilte, tv-rør og som kølemiddel til kryogenik |
| Argon (Ar) | Anvendes i pærer, svejsning og som inert gas i laboratorier |
| Krypton (Kr) | Anvendes i blitzlamper, stroboskoplys og som kølemiddel til kryogenik |
| Xenon (Xe) | Som krypton brugt i blitzlamper, stroboskoplys og som kølemiddel til kryogenik |
| Radon (Rn) | Er en radioaktiv gas og anvendes ikke kommercielt |
Disse gasser betragtes som kemisk inerte, hvilket betyder, at de ikke deltager i kemiske reaktioner, og derfor danner de ikke forbindelser. De kan dog tvinges til at reagere under højt tryk eller ekstreme temperaturer.
